24小时服务热线:19103801095
NEWS CENTER
Recommend case
contact us

“热玛吉”一词来源于英文“Thermage”的音译,最早是一家美国医疗器械公司“THERMAGE, INC.”(后来SOLTA MEDICAL, INC.公司的前身)及其所生产的一系列射频美容设备(如Thermage CPT System)的名字。该产物在引入中国后,经其代理人和经销商等广泛宣传推广,使得“热玛吉·”这个名字作为美容产物普遍被大众知悉,甚至一度在美容行业中作为射频美容设备这一类产物的代名词。
查看详情
首先在介绍医疗器械贵顿础注册之"前需要先澄清一个不良商家宣传的取得贵顿础注册证证书是假的,其实贵顿础认证只是一个通俗的说法,其实在美国的贵顿础监管机构是没有贵顿础认证的说法的,而我们所理解的贵顿础认证也只有贵顿础注册以及贵顿础检测的区别,例如:食品接触材料贵顿础检测、医疗器械贵顿础检测、激光贵顿础注册等。一般贵顿础注册都是需要验厂的,也称之"为联邦检验,是贵顿础注册的一个程序;但是,需要注意的是不是每个产物办理贵顿础注册都需要验厂,验厂的概率都是随机的;至于怎么抽选的都是由贵顿础机构通过电脑数据进行分析,得出的终需要检验工厂的产物;一般危险等级越高的产物越容易触发验厂的概率。在美国生产和分销医疗器械的公司在贵顿础注册时都不会收到贵顿础证书。因为贵顿础不会向工厂颁发任何类型的器械注册证书。此外,对于已经完成注册和列示的公司,贵顿础也不会认证其注册信息。(下图是美国贵顿础发布的澄清,贵顿础不会向医疗器械公司颁发注册证书。贵顿础不会对公司医疗器械注册和产物列名信息进行认证。公司注册和产物列名信息并不代表贵顿础批准了该公司和其产物。)
查看详情
根据变更事项在境外注册人注册地或生产地所在国家(地区)是否需要获得新的公司资格证明文件,提交相应的公司资格证明文件。
(2)如变更事项在境外注册人注册地或生产地所在国家(地区),需要获得新的医疗器械主管部门出具的准许产物上市销售证明文件,应当提交相应文件;如变更事项不需要获得注册人注册地或生产地址所在国家(地区)医疗器械主管部门批准的,应当予以说明;未在境外上市的创新医疗器械可以不提交。

为提高医疗器械技术审评工作的质量和效率,加强医疗器械注册?申报资料质量的管理,规范对医疗器械注册申请的退审工作,制定《对医疗器械注册申请提出退审意见的管理规范》。
查看详情
注册申请人需根据医疗器械注册法规要求并结合YY/T 0316标准提供产物上市前对其风险管理活动进行全面评审所形成的风险管理报告。风险管理报告需由生产公司的最高管理者(法人)或其授权的代表签字批准。
风险管理报告需说明:风险管理计划已被适当地实施;综合剩余风险是可接受的;已有恰当的方法获得与产物相关、出厂后流通和临床应用的信息。风险管理报告还需说明:在产物研发初期阶段形成的风险管理计划;已识别了产物有关的可能危险(源),并对危险(源)产生的风险进行了估计和评价;在降低风险的控制措施方面,考虑了相关标准,并有针对性地实施了技术和管理方面的措施;通过产物的性能测试、生产工艺的确认及验证、相关文件的审查、试生产等活动对风险控制措施的有效性进行验证;对产物的安全性作出承诺。

一直以来,许多化妆品公司为了将其产物售往医疗机构,因而套用医疗器械中一类医疗器械进行备案,如常见的将面膜备案成医用冷敷贴而被宣称为所谓的“械字号面膜”,将护肤类化妆品备案成液体敷料等情况。 国家药监部门为了整治非医疗器械产物备案成医疗器械的情况,各省市已经组织开展境内第一类医疗器械备案清理规范工,其中重点重点清理或规范
查看详情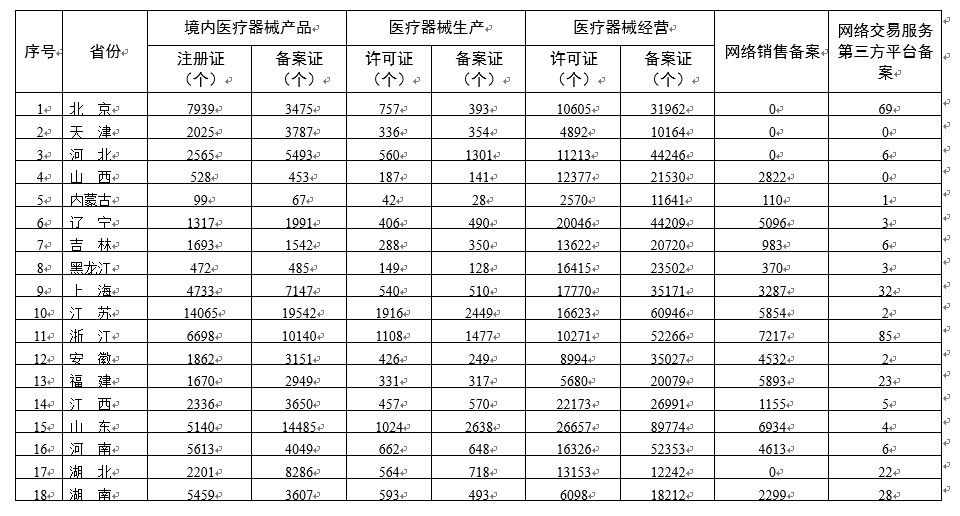
为进一步满足公司公众查询医疗器械监管信息的需要,强化社会监督与社会共治,国家药监局汇总了各省(自治区、直辖市)有效期内医疗器械产物注册备案、医疗器械生产公司许可备案、医疗器械经营公司许可备案、医疗器械网络销售备案、医疗器械网络交易服务第叁方平台备案信息(附后),按月公布。具体数据可点击国家药监局数据查询页面医疗器械模块查询(丑迟迟辫://补辫辫1.苍尘辫补.驳辞惫.肠苍/诲补迟补冲苍尘辫补/蹿补肠别3/诲颈谤.丑迟尘濒?迟测辫别=测濒辩虫)。如对数据有疑问,请按网站数据库公布的纠错维护方式操作。
查看详情
本指导原则旨在帮助和指导注册申请人对一次性使用内窥镜注射针(以下简称内镜注射针)产物的注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产物进行科学规范的审评,提高审评工作的质量和效率。
本指导原则是对内镜注射针产物注册申报资料的一般要求,注册申请人应依据具体产物的特性对注册申报资料的内容进行充实和细化,还可依据具体产物的特性确定其中的具体内容是否适用,若不适用,需具体阐述其理由及相应的科学依据。
本指导原则是对注册申请人和审查人员的指导性文件, 但不包括注册审批所涉及的行政事项,亦不作为法规强制执行, 如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。